- ACÉTONE
- ACÉTONEACÉTONELiquide volatil incolore, d’une odeur piquante, miscible avec l’eau, l’alcool, l’éther, le chloroforme et le benzène, l’acétone, ou diméthylcétone, ou propan-2-one, a pour formule
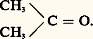 Ses caractéristiques sont les suivantes:Masse moléculaire: 58,08 gMasse spécifique: 0,789 g/cm3Point de fusion: — 95,3 0CPoint d’ébullition: 56,2 0CIl existe trois procédés principaux de préparation industrielle de l’acétone. Le procédé au cumène , exploité depuis les années cinquante, est actuellement le plus important; le cumène est oxydé en hydropéroxyde de cumène qui est ensuite décomposé en acétone et phénol. La déshydrogénation ou l’oxydation de l’isopropanol vient en deuxième place; elle s’effectue suivant deux variantes technologiques en phase gazeuse ou en phase liquide. Le troisième procédé, celui d’oxydation du propène , s’effectue en phase liquide avec l’oxygène de l’air en présence d’un système catalytique à base de palladium. L’acétone est aussi obtenue comme sous-produit dans la synthèse du glycérol à partir de l’acroléine. Comme autres méthodes de moindre importance on peut signaler l’oxydation sans catalyseur du mélange butane-propane, et la fermentation de produits renferment de l’amidon.L’acétone est utilisée directement, pour un quart environ de sa production, comme solvant de produits divers (peintures, vernis, laques, résines naturelles, colorants, graisses et huiles) et comme solvant de nettoyage et de séchage d’équipements spéciaux. Par ailleurs, l’acétone sert d’intermédiaire de synthèse pour d’autres produits comme le méthylisobutylcétone, l’oxyde de mésityle, le méthacrylate de méthyle, le bisphénol A, etc.L’acétone est le dérivé le plus simple de la série des cétones aliphatiques. La présence de la double liaison carbone-oxygène lui confère l’essentiel de sa réactivité; la polarisation de cette double liaison entraîne l’attaque des réactifs nucléophiles sur le carbone du carbonyle. La présence de doublets libres (orbitales non liantes) sur l’atome d’oxygène permet la complexation avec les acides de Brönsted ou de Lewis et de ce fait la catalyse des réactions nucléophiles. Enfin les hydrogènes des groupes méthyle sont assez acides pour être arrachés par une base forte et pour permettre des réactions de condensation sur d’autres substrats.L’acétone peut être réduite en isopropanol par hydrogénation catalytique (H2, Ni) ou par réduction chimique (LiAlH4). L’eau et les alcools s’additionnent réversiblement pour donner respectivement un hydrate et un hémicétal (ou un cétal si l’alcool est en excès), l’équilibre étant fortement déplacé vers l’acétone. L’addition de NaHS3 donne une combinaison bisulfitique. Les composés azotés s’additionnent à l’acétone pour donner des dérivés comme les oximes, les hydrazones ou les semicarbazones qui sont souvent cristallisés. L’addition des organo-magnésiens (réactifs de Grignard) conduit aux alcools tertiaires. L’acétone réagit avec le brome pour donner des dérivés mono- ou polybromés. En milieu basique, l’acétone se condense sur elle-même (cétolisation) pour donner à basse température le diacétonealcool; par chauffage en présence d’un acide on obtient l’oxyde de mésityle. Enfin, l’acétone additionne l’acide cyanhydrique pour donner une cyanhydrine qui est déshydratée industriellement en présence de méthanol et l’acide sulfurique pour former le méthacrylate de méthyle.
Ses caractéristiques sont les suivantes:Masse moléculaire: 58,08 gMasse spécifique: 0,789 g/cm3Point de fusion: — 95,3 0CPoint d’ébullition: 56,2 0CIl existe trois procédés principaux de préparation industrielle de l’acétone. Le procédé au cumène , exploité depuis les années cinquante, est actuellement le plus important; le cumène est oxydé en hydropéroxyde de cumène qui est ensuite décomposé en acétone et phénol. La déshydrogénation ou l’oxydation de l’isopropanol vient en deuxième place; elle s’effectue suivant deux variantes technologiques en phase gazeuse ou en phase liquide. Le troisième procédé, celui d’oxydation du propène , s’effectue en phase liquide avec l’oxygène de l’air en présence d’un système catalytique à base de palladium. L’acétone est aussi obtenue comme sous-produit dans la synthèse du glycérol à partir de l’acroléine. Comme autres méthodes de moindre importance on peut signaler l’oxydation sans catalyseur du mélange butane-propane, et la fermentation de produits renferment de l’amidon.L’acétone est utilisée directement, pour un quart environ de sa production, comme solvant de produits divers (peintures, vernis, laques, résines naturelles, colorants, graisses et huiles) et comme solvant de nettoyage et de séchage d’équipements spéciaux. Par ailleurs, l’acétone sert d’intermédiaire de synthèse pour d’autres produits comme le méthylisobutylcétone, l’oxyde de mésityle, le méthacrylate de méthyle, le bisphénol A, etc.L’acétone est le dérivé le plus simple de la série des cétones aliphatiques. La présence de la double liaison carbone-oxygène lui confère l’essentiel de sa réactivité; la polarisation de cette double liaison entraîne l’attaque des réactifs nucléophiles sur le carbone du carbonyle. La présence de doublets libres (orbitales non liantes) sur l’atome d’oxygène permet la complexation avec les acides de Brönsted ou de Lewis et de ce fait la catalyse des réactions nucléophiles. Enfin les hydrogènes des groupes méthyle sont assez acides pour être arrachés par une base forte et pour permettre des réactions de condensation sur d’autres substrats.L’acétone peut être réduite en isopropanol par hydrogénation catalytique (H2, Ni) ou par réduction chimique (LiAlH4). L’eau et les alcools s’additionnent réversiblement pour donner respectivement un hydrate et un hémicétal (ou un cétal si l’alcool est en excès), l’équilibre étant fortement déplacé vers l’acétone. L’addition de NaHS3 donne une combinaison bisulfitique. Les composés azotés s’additionnent à l’acétone pour donner des dérivés comme les oximes, les hydrazones ou les semicarbazones qui sont souvent cristallisés. L’addition des organo-magnésiens (réactifs de Grignard) conduit aux alcools tertiaires. L’acétone réagit avec le brome pour donner des dérivés mono- ou polybromés. En milieu basique, l’acétone se condense sur elle-même (cétolisation) pour donner à basse température le diacétonealcool; par chauffage en présence d’un acide on obtient l’oxyde de mésityle. Enfin, l’acétone additionne l’acide cyanhydrique pour donner une cyanhydrine qui est déshydratée industriellement en présence de méthanol et l’acide sulfurique pour former le méthacrylate de méthyle.
acétone [ asetɔn ] n. f.• 1833; de acét(ique) et suff. chim. -one♦ Corps le plus simple du groupe des cétones (CH3COCH3 ), liquide incolore, inflammable, d'odeur caractéristique, utilisé comme solvant.
● acétone nom féminin Composé CH3―CO―CH3, initialement préparé par pyrolyse de l'acétate de calcium. ● acétone (synonymes) nom féminin Composé CH 3 ―CO―CH 3 , initialement préparé par pyrolyse...Synonymes :- diméthylcétoneacétonen. f. CHIM Liquide incolore (CH 3 -CO-CH 3), très volatil, d'odeur éthérée, le représentant le plus simple de la famille des cétones. L'acétone est un excellent solvant organique.⇒ACÉTONE, subst. fém.CHIM. Corps organique, de formule CH3COCH3, premier terme de la série des cétones; nommé propanone, suivant la nomenclature rigoureuse :• 1. On appelle acétone un liquide limpide, incolore, inflammable, volatil, d'une odeur éthérée, et qui se produit dans la distillation sèche des acétates.Ch.-A. WURTZ, Dict. de chimie pure et appliquée, t. 1, 1869-1878, p. 31.• 2. [l'] Acétone (...) [se] recueille dans la distillation sèche du bois.Ch. COFFIGNIER, Les Vernis, 1921, p. 367.Rem. Sa découverte dans les produits de distillation du bois lui a valu les noms de esprit pyroligneux ou pyroacétique.• 3. L'acétone, liquide incolore, d'odeur chloroformique, existe incontestablement dans l'urine de certains diabétiques...LE GENDRE ds (F. Widal, P.-J. Teissier, G.-H. Roger, Nouveau traité de médecine, 1920-1924, fasc. 7, p. 435).• 4. Acétone. Puissant dissolvant de l'encre.Ch.-L. CARABELLI, [Langue de l'imprimerie].Prononc. :[ ].Étymol. ET HIST. — 1853 chim. « liquide incolore d'odeur éthérée, volatil, inflammable, utilisé comme solvant » (LA CHÂTRE t. 1 : Acétone. Liquide incolore, très limpide, très volatil, d'une odeur éthérée et pénétrante...).Dér. du rad. du lat. acetum « vinaigre »; suff. -one, suff. spécifique des cétones dans la nomenclature chim.BBG. — BOUILLET 1859. — CHESN. 1857. — DELORME 1962. — FROMH.-KING 1968. — GRAND. 1962. — LITTRÉ-ROBIN 1865. — MONT. 1967. — Pétrol. 1964. — PRIVAT-FOC. 1870. — Sc. 1962. — UV.-CHAPMAN 1956.acétone [asetɔn] n. f.ÉTYM. 1833, Bussy; de acét(o)-, et suff. -one de eupione, margarone, devenu ensuite suff. spécifique des cétones.❖♦ Chim. Corps le plus simple du groupe des cétones (CH3COCH3), liquide incolore, d'odeur pénétrante, volatil et inflammable, utilisé comme solvant.❖DÉR. et COMP. Acétonémie, acétonurie; cétone. REM. De nombreux autres composés sont attestés en chimie (acétone-dicarboxylate, n. m.; acétonitrile, n. m.; acétonylacétone, n. m.) et en médecine.
].Étymol. ET HIST. — 1853 chim. « liquide incolore d'odeur éthérée, volatil, inflammable, utilisé comme solvant » (LA CHÂTRE t. 1 : Acétone. Liquide incolore, très limpide, très volatil, d'une odeur éthérée et pénétrante...).Dér. du rad. du lat. acetum « vinaigre »; suff. -one, suff. spécifique des cétones dans la nomenclature chim.BBG. — BOUILLET 1859. — CHESN. 1857. — DELORME 1962. — FROMH.-KING 1968. — GRAND. 1962. — LITTRÉ-ROBIN 1865. — MONT. 1967. — Pétrol. 1964. — PRIVAT-FOC. 1870. — Sc. 1962. — UV.-CHAPMAN 1956.acétone [asetɔn] n. f.ÉTYM. 1833, Bussy; de acét(o)-, et suff. -one de eupione, margarone, devenu ensuite suff. spécifique des cétones.❖♦ Chim. Corps le plus simple du groupe des cétones (CH3COCH3), liquide incolore, d'odeur pénétrante, volatil et inflammable, utilisé comme solvant.❖DÉR. et COMP. Acétonémie, acétonurie; cétone. REM. De nombreux autres composés sont attestés en chimie (acétone-dicarboxylate, n. m.; acétonitrile, n. m.; acétonylacétone, n. m.) et en médecine.
Encyclopédie Universelle. 2012.
